Можно ли проходить барокамеру после 6 курсов ПХТ опухоли брюшины?
Новый метод лечения канцероматоза брюшины
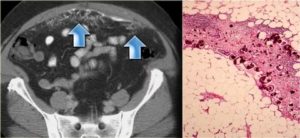
Ежегодно во всем мире многие пациенты сталкиваются с диагнозом «канцероматоз брюшины». К ним относится целый ряд онкологических заболеваний – в том числе и пациенты с такими относительно редкими заболеваниями как злокачественная мезотелиома и псевдомиксома брюшины (ПМБ).
Однако намного чаще канцероматоз брюшины возникает в результате распространения метастазов при первоначальном рака яичников или желудка, например.
Еще не так давно канцероматоз брюшины было крайне сложно лечить, так как болезнь развивается агрессивно, у пациентов развивался тяжелый асцит, качество жизни значительно ухудшалось и прогноз у таких пациентов был крайне неблагоприятным.
К счастью, методы лечения подобных тяжелых диагнозов, таких как эрозивный бульбит, все время развивается и совершенствуется.
Один из таких новых методов лечения заключается в хирургическом удалении всей видимой опухоли из брюшной полости с последующим промыванием «горячей химиотерапией».
Медицинским языком это называется «циторедуктивная операция» (ЦРО) и «гипертермическая интраперитонеальная химиотерапия» (hyperthermic intra-peritoneal chemotherapy).
Если объяснить все проще, то по сути это хирургическое удаление всех доступных (видимых) участков опухоли, а все остаточные раковые клетки затем уничтожается с помощью высокоактивной химиотерапии, которая заливается в брюшную полость, по сути это применение химиотерапии местно.Что примечательно, химический препарат подогревается до 41 градусов с помощью специального устройства, и таким образом повышается его эффективность и шанс уничтожить все раковые клетки.
Благодаря такому комплексному подходу онкологи добиваются значительного увеличения продолжительности жизни и снижают риск рецидива болезни, и в некоторых случаях улучшается качество жизни пациента.
Так как HIPEC весьма агрессивная процедура, существует множество факторов, которые влияют на целесообразность применения этого протокола для каждого отдельного пациента. Именно поэтому проводить лечение должны профессионалы, специализирующие на этой процедуре, а подбирать мультидисциплинарный центр, авторизированный ее проводить, нужно доверить только компетентным медицинским координаторам.
Понятно, что HIPEC — вмешательство достаточно масштабное, длительность операции колоссальна (может занимать до 10 часов под общим наркозом) и даже само описание протокола выглядит пугающе — применяются токсичные препараты, хирургическая часть больше напоминает разбор конструктора, в процессе даже участвует электрический ток.
Однако наш опыт показал, что применение HIPEC усложняет процесс восстановления после операции не критично, а долгосрочная польза для пациента очевидна – этот неоднозначный протокол может быть очень эффективным инструментом спасения жизни и здоровья даже в крайне тяжелых случаях.
При этом добавление HIPEC к стандартному хирургическому лечению не приводило к росту уровня осложнений или числа смертей, связанных с проводимым лечением.
Для каких пациентов подходит?
HIPEC-лечение в настоящее время считается стандартом медицинской помощи во многих странах для пациентов с мезотелиомой, псевдомиксомой брюшины и пациентами с раком брюшины, первично вызванной колоректальной опухолью. Некоторые клинические центры также применяют HIPEC по другим показаниям, например, при канцероматозе брюшины при первичном раке желудка или яичников.
, наглядно демонстрирующее применение HIPEC:
Ниже мы подготовили и перевели резюме исследования, которое было опубликовано в январе 2018 года в медицинском журнале The New England Journal of Medicine, результаты которого указывают на существенное повышение выживаемости пациенток с распространенным раком яичников, получавших лечение HIPEC. И по результатам, в среднем пациентки, получавшие лечение в сочетании с HIPEC, жили на 12 месяцев дольше, чем пациенты без проведения HIPEC.
Исследование было проведено в Нидерландах доктором Виллемин ван Дрил и командой ученых, специализирующихся на данной проблеме.
По словам онкохирурга доктора Игнаса де Хингх, президента Голландской группы по перитонеальной онкологии, это исследование является крупным шагом вперед в лечении рака яичников.«Это весьма обнадеживающий результат, и в настоящее время мы ищем способы внедрения данного метода лечения в голландскую систему здравоохранения».
Традиционно лечение впервые выявленного рака яичников на поздних стадиях обычно включает проведение циторедуктивной операции и системной химиотерапии.
И данное исследование проводилось с целью понять, позволяет ли проведение гипертермической интраперитонеальной химиотерапии (HIPEC) в качестве дополнения к интервальной циторедуктивной операции улучшить прогнозы у пациенток, получающих неоадъювантную химиотерапию по поводу эпителиального рака яичников III стадии.
В рамках многоцентрового открытого исследования III фазы авторы рандомизировано разделили 245 пациенток (с достигнутой стабилизацией заболевания после трех циклов химиотерапии карбоплатином и паклитакселом) на проведение интервальной циторедуктивной операции с или без назначения HIPEC с применением цисплатина. Рандомизацию проводили непосредственно во время хирургического вмешательства в тех случаях, когда полагали, что в результате операции можно достичь отсутствия видимых проявлений заболевания (полная циторедукция) или сохранения лишь одного или нескольких остаточных опухолевых очагов размером 10 мм и менее в диаметре (оптимальная циторедукция). В послеоперационном периоде проводили три дополнительных цикла химиотерапии карбоплатином и паклитакселом. Первичной конечной точкой была безрецидивная выживаемость. Общая выживаемость и профиль побочных эффектов были ключевыми вторичными конечными точками.
Результаты
По результатам анализа всех включенных пациенток, рецидив заболевания или смерти были зарегистрированы у 110 из 123 (89%) пациенток с выполненной циторедуктивной операцией без HIPEC (группа хирургического вмешательства) и у 99 из 122 (81%) пациенток с выполненной циторедуктивной операцией в сочетании с HIPEC (группа хирургического вмешательства плюс HIPEC).
Медиана безрецидивной выживаемости составила 10,7 месяца в группе проведения хирургического вмешательства и 14,2 месяца в группе проведения хирургического вмешательства плюс HIPEC. При медиане последующего наблюдения 4,7 года умерли 76 (62%) пациенток из группы проведения хирургического вмешательства и 61 (50%) пациентка из группы проведения хирургического вмешательства плюс HIPEC.
Медиана общей выживаемости составила 33,9 месяца в группе проведения хирургического вмешательства и 45,7 месяца в группе проведения хирургического вмешательства плюс HIPEC.
Доли пациенток с нежелательными явлениями 3 или 4 степени тяжести были сходными в двух группах лечения (25% в группе проведения хирургического вмешательства и 27% в группе проведения хирургического вмешательства плюс HIPEC).
Выводы
У пациенток с эпителиальным раком яичников III стадии HIPEC в качестве дополнения к интервальной циторедуктивной операции способствовала достижению более длительной безрецидивной выживаемости и общей выживаемости по сравнению с проведением только лишь хирургического вмешательства и не приводила к повышению частоты развития побочных эффектов.
Эффективность
В процессе последующего наблюдения продолжительностью 4,7 года у 209 из 245 (85%) был зарегистрирован рецидив заболевания или смерть пациента; медиана безрецидивной выживаемости была длительнее на 3,5 месяца в группе проведения циторедуктивной операции в сочетании с HIPEC по сравнению с группой проведения только лишь хирургического вмешательства (14,2 месяца относительно 10,7 месяца).
Вероятность безрецидивной выживаемости спустя 3 года составила 8% в группе проведения хирургического вмешательства и 17% в группе проведения хирургического вмешательства плюс HIPEC.
Общая выживаемость составила 33,9 месяца в группе проведения хирургического вмешательства и 45,7 месяца в группе проведения хирургического вмешательства плюс HIPEC. Вероятность общей выживаемости спустя 3 года составила 48% в группе проведения хирургического и 62% в группе проведения хирургического вмешательства плюс HIPEC.
Безопасность и качество жизни
В целом у более чем у 95% пациенток из обеих групп возникло как минимум одно нежелательное явление вне зависимости от степени тяжести в период от момента рандомизации до 6-й недели после завершения последнего цикла химиотерапии.
Но между двумя группами не было зарегистрировано значимых различий в частоте развития нежелательных явлений любой степени тяжести.
Нежелательные явления 3 или 4 степени были зарегистрированы у 30 (25%) пациенток из группы проведения хирургического вмешательства и у 32 (27%) пациенток из группы проведения хирургического вмешательства плюс HIPEC.В обеих группах лечения самыми частыми нежелательными явлениями 3 или 4 степени тяжести были боль в животе, инфекция и кишечная непроходимость. В группе хирургического вмешательства был зарегистрирован один случай со смертельным исходом в пределах 30 дней после проведения операции.
Резекция кишечника была выполнена 59 пациенткам: 30 пациенткам из группы проведения хирургического вмешательства и 29 пациенткам из группы проведения хирургического вмешательства плюс HIPEC.
Среди пациенток с выполненной резекцией кишечника колостомию или илеостомию чаще проводили пациенткам из группы проведения хирургического вмешательства плюс HIPEC (21 из 29 [72%] пациенток), чем пациенткам из группы проведения хирургического вмешательства (13 из 30 [43%] пациенток).
Общая длительность госпитализации составила 8 дней в группе проведения хирургического вмешательства и 10 дней в группе проведения хирургического вмешательства плюс HIPEC, включая 1 день пребывания в отделении реанимации и интенсивной терапии в соответствии с требованиями протокола. Период времени между завершением хирургического вмешательства и возобновлением химиотерапии после операции была сходной в двух группах (30 дней в группе проведения хирургического вмешательства и 33 дня в группе проведения хирургического вмешательства плюс HIPEC). Частота завершения всех трех циклов химиотерапии после хирургического вмешательства была также сходной в двух группах (90% в группе проведения хирургического вмешательства и 94% в группе проведения хирургического вмешательства плюс HIPEC соответственно).
Источник: https://patient-mt.ru/novosti-i-stati/novosti-kompanii/novyy-metod-lecheniya-kantseromatoza-bryushiny-/
4 или 6 курсов химиотерапий
В зависимости от состояния пациента, специалист назначает определенное количество процедур — 4 или 6 химиотерапий. Основным решающим фактором является наличие количества раковых клеток, чем их больше, тем интенсивнее и сильнее должны быть медикаментозные препараты.
6 химиотерапий — это много?
Чтобы устранить развивающуюся онкологию, необходимо использовать не только оперативный метод, но и применять несколько курсов химиотерапии, например, шесть. Количество подобных процедур невозможно предугадать заранее, поэтому специалисты после каждого сеанса, цикла и курса обязательно берут анализы в человека.
Благодаря применению химиотерапии, происходит замедление развития и жизнедеятельности раковых клеток, или происходит их полное уничтожение, если заболевание обнаружилось в человека на начальных стадиях и не появились метастазы. В случае возникновения вопросов — что такое цикл, или все о химиотерапии, расскажет лечащий врач онколог. Злокачественные образования чаще всего располагаются в зонах:
- возле кровеносных сосудов;
- имеющих прямой доступ к кислороду.
Подобное расположение очень затрудняет оперативное вмешательство (цикл операции), опасность которого заключается в риске повредить кровеносные сосуды или артерии, и вызвать сильное внутреннее или внешнее кровотечение, поэтому специалисты назначают курсами от 4 до 6 химиотерапий, облегчая состояние пациента, и спасая ему жизнь. Между сеансами лечения существует определенный промежуток, который позволяет организму немного восстановиться после перенесенного стресса.
Допустимый перерыв между курсами — при интенсивной терапии ее длительность может колебаться от 1 до нескольких дней, а период отдыха составлять несколько месяцев.
Самая сильная — интенсивная химиотерапия (VI курсов), ее минусом является цена, и резкое влияние на организм.
Положительным моментом подобного действия выделяют невозможность организма пациента привыкнуть к используемым препаратам и высокий процент эффективности в воздействия на раковые новообразования.
Как вести себя пациенту во время процедуры химиотерапии
Много больных задают вопрос — сколько дней длиться один курс, и каковы ограничения во время подобной процедуры, влияет ли это на цену курса. Разрешаются легкие физические нагрузки на мышцы и суставы, гимнастика и йога, позволяющие поднять настроение и повысить гибкость.
Во время 6 химиотерапий, если в организме не наблюдаются аллергические реакции, и нет проблем с желудочно-кишечной системой и почками, нужно часто пить фруктовые и овощные соки — по пол стакана ежедневно, обычную питьевую воду, общее количество выпитой жидкости должно составлять около 2 литров.
Запрещается употребление газированных и алкогольных напитков во время проведения 6 химиотерапии, противопоказано курение, а перед питьем минеральной воды, необходимо проконсультироваться с лечащим врачом.
К запретам относится сауна, загар на открытом солнце и солярий, одежду необходимо иметь с длинным рукавом, нельзя использовать горячий душ или ванну.
Психологическая поддержка при 6 химиотерапии
Процедура 6 химиотерапий способна кардинально изменить не только образ жизни пациента, но и его черты характера, при использовании медицинских препаратов, происходят необратимые процессы в нервной системе человека. Почему перед операцией и комплексом из 6 химиотерапий больному рекомендуют положительные эмоции и избегание стрессов:
- наличие гормонов счастья позволяет организму легче справляться с возникшими нагрузками;
- человек находит в себе силы для дальнейшей борьбы с заболеванием;
- самовнушение играет также первостепенную роль, как и применение лекарственных средств.
После 2 стадии онкологии, нужно прибегать к использованию 6 химиотерапий, совместно с оперативным вмешательством. Применение комплексных методов борьбы с возникшим заболеванием позволяет избежать увеличения новообразования, и его распространения на близлежащие внутренние органы и системы.
Специалисты рекомендуют, перед проведением сеанса 6 химиотерапий, найти для себя новое увлечение, заняться чтением интересной книги или начать рукодельничать.
Лучше ставить для себя одну или две реальные цели, которыми можно заняться после 6 химиотерапий. Различные способы расслабления помогут снять напряжение с мышц, успокоить возбужденную нервную систему и находиться в хорошем настроении. Лечащему врачу необходимо задавать все возникшие вопросы, это позволит избежать непонимания и лишних стрессов.
Как проходит курс лечения — специалист определяет дозы препарата, правила введения или приема, и наблюдает положительную или отрицательную динамику деятельности раковых новообразований после курса 6 химиотерапий.
Если лечение прошло успешно, подобные процедуры могут не повторятся, в запущенных случаях необходимо несколько курсов, чтобы прекратить рост опухоли и устранить распространение болезни.Онкологическая клиника в Израиле, принимает на лечение иностраныз граждан Подробнее лечения онкологии в Израиле вы можете ознакомиться на сайте клиники http://assutatop.com/
Источник: https://alloncology.com/articles/14/8/
Лечение больных раком желудка с канцероматозом брюшины. Современный взгляд и перспективы
Рак желудка удерживает 5-е место в структуре онкологической заболеваемости в мире и 3-е в структуре смертности от злокачественных новообразований [1]. Перинеальная диссеминация является одним из наиболее частых и неблагоприятных вариантов прогрессирования при раке желудка.
По данным литературы, синхронный карциноматоз отмечается у 14—43% больных раком желудка, в том числе изолированное поражение брюшины — у 10% [2, 3]. При этом перитонеальный рецидив развивается в 10—46% наблюдений после «радикального» хирургического лечения и является единственным проявлением заболевания у 12—40% больных [4—6].
По данным исследований секционного материала, перитонеальный карциноматоз является причиной смерти 51% больных первичным нерезектабельным раком желудка [7].
Факторами риска развития перитонеального карциноматоза являются инвазия серозной оболочки, поражение регионарных лимфатических узлов, диффузный тип рака и наличие свободных опухолевых клеток в брюшной полости [8].
На протяжении долгого времени развитие перитонеальной диссеминации при раке желудка рассматривалось как терминальная стадия заболевания с медианой выживаемости 3—6 мес, причем прогноз при карциноматозе хуже, чем при других вариантах метастазирования [9].
В настоящее время основным специальным методом лечения больных диссеминированным раком желудка является системная химиотерапия, однако частота объективного ответа при перитонеальных метастазах ниже, чем при висцеральных, и не превышает 14—25% с медианой выживаемости 8—10 мес [10, 11].
В нашей стране большинству больных раком желудка с перитонеальной диссеминацией проводят симптоматическую терапию в виде повторных лапароцентезов, а специальные методы лечения перитонеального карциноматоза, такие как циторедуктивные операции в сочетании с различными вариантами внутрибрюшной химиотерапии, проводятся только в высокоспециализированных центрах у небольшого числа пациентов.
За последние десятилетия были разработаны и внедрены в клиническую практику различные методы внутрибрюшного воздействия в сочетании с хирургической циторедукцией или в самостоятельном варианте, которые показали свою эффективность при различных диссеминированных поражениях брюшины: раке яичников, муцинозных опухолях червеобразного отростка, колоректальном раке и мезотелиоме [12, 13]. По раку желудка опубликованные результаты рандомизированных и нерандомизированных исследований зачастую носят противоречивый характер. С одной стороны, они подтверждают эффективность внутрибрюшной терапии при тщательном отборе больных, с другой — ни один из методов не стал стандартом лечения при раке желудка с перитонеальной диссеминацией, продолжая оставаться предметом экспериментальных протоколов лечения в условиях специализированных клиник. В представленном материале обобщен мировой опыт лечения больных раком желудка с перитонеальным карциноматозом, а также представлен опыт торакоабдоминального отделения МНИОИ им. П.А. Герцена по применению всех видов внутрибрюшной терапии, в том числе в сочетании с хирургическим лечением и в самостоятельном варианте.
Патофизиологические аспекты развития перитонеального карциноматоза при раке желудка
Развитие перитонеальной диссеминации при раке желудка является следствием двух основных механизмов.
Первый заключается в спонтанной эксфолиации свободных опухолевых клеток с поверхности пораженной серозной оболочки желудка; при этом чем больше площадь поражения серозы, тем выше частота обнаружения свободных опухолевых клеток в брюшной полости, что является эквивалентом последующего развития карциноматоза [14].
Второй механизм заключается в ятрогенной диссеминации опухолевых клеток при мобилизации пораженного опухолью желудка, лимфатических узлов, пересечении лимфатических и кровеносных сосудов, в результате чего отдельные опухолевые клетки и эмболы попадают в свободную брюшную полость, захватываются фибриновыми сгустками и начинают локальный рост под воздействием ростовых факторов, выделяющихся в ходе раневого процесса («теория захвата опухолевых клеток» по P. Sugarbaker) [15]. Подобный рост «захваченных» клеток в условиях гипоксического микроокружения делает их малоуязвимыми для системной химиотерапии. Описан и лимфогенный путь распространения свободных клеток через серозно-лимфатические люки (stomata), соединяющие свободную брюшную полость с лимфатическими сосудами и щелями париетальной и висцеральной брюшины [16]. Показано, что интраоперационное кровотечение увеличивает риск развития перитонеального рецидива [17].Как показали исследования, опухолевые клетки, участвующие в процессе перитонеальной диссеминации, отличаются от клеток первичной опухоли по генетическому профилю, что выражается в активации или угнетении экспрессии различных генов, отвечающих за клеточную адгезию, инвазию, пролиферацию, передачу внутриклеточного сигнала и иммунный ответ [18]. Предполагается, что обнаруженные генетические маркеры могут стать потенциальной мишенью для новых таргетных препаратов, эффективных с точки зрения профилактики и лечения перитонеального карциноматоза.
Роль хирургической циторедукции в лечении больных с карциноматозом брюшины при раке желудка
Самостоятельное хирургическое лечение при раке желудка является малоэффективным и не оказывает существенного влияния на прогноз заболевания. Удаление первичной опухоли может иметь паллиативный эффект при осложненном опухолевом процессе (перфорация, кровотечение, распад опухоли) [19].
Попытки удаления пораженной брюшины и отдельных узлов-диссеминатов также не приводят к успеху, поскольку согласно той же самой «теории захвата опухолевых клеток» подобные вмешательства вызывают дополнительную диссеминацию и быстрый продолженный рост [15].
Исключение могут составлять единичные отсевы вблизи желудка.
Между тем хирургическая циторедукция является ключевым фактором при реализации комбинированных методик лечения больных с карциноматозом, таких как гипертермическая внутрибрюшная химиотерапия.
В связи с малой глубиной воздействия цитостатиков даже в условиях гипертермии (см. ниже) именно полнота хирургической циторедукции в конечном счете определяет успешность всей программы лечения.
С целью стандартизации полноты циторедукции при хирургическом лечении больных с перитонельным карциноматозом P.
Sugarbaker предложил метод оценки, основанный на размере остаточной опухоли в максимальном ее измерении, исходя из того, что максимальная глубина проникновения цисплатина при внутрибрюшном введении не превышает 2,5 мм (рис. 1) Рис. 1.Оценкаполнотыциторедукции (СС) (Completeness of cytoreduction). [20].
По данным O. Glehen и соавт. [12], полнота циторедукции достоверно влияла на выживаемость больных раком желудка с карциноматозом после проведения внутрибрюшной гипертермической химиотерапии (HIPEC) (рис. 2). Рис. 2.
Влияние полноты циторедукции на выживаемость больных диссеминированным раком желудка после выполнения циторедуктивных операций с HIPEC (O. Glehen и соавт., 2010).Таким образом, только циторедукция в объеме СС0—СС1 является полной и позволяет рассчитывать на достижение долговременной выживаемости при лечении перитонеального карциноматоза с использованием внутрибрюшной химиотерапии.
Фармакологические аспекты внутрибрюшной химиотерапии
Как было отмечено выше, перитонеальные метастазы малоуязвимы для системной лекарственной терапии благодаря наличию париетально-плазменного барьера, однако это свойство брюшины имеет и положительный момент, поскольку позволяет осуществлять внутрибрюшное введение высоких доз цитостатиков без развития системной токсичности.
Для реализации максимального эффекта такой цитостатик должен иметь ряд фармакологических характеристик: высокую молекулярную массу, что определяет низкий системный клиренс; достаточную глубину проникновения в ткани (от нескольких клеточных слоев до 2—3 мм); синергизм с гипертермией при использовании методики HIPEC; цитотоксический эффект независимо от фазы клеточного цикла [22, 23].
На сегодняшний день для внутрибрюшной химиотерапии используется широкий перечень цитостатиков, каждый из которых имеет свои достоинства и недостатки (табл. 1) Таблица 1. Сравнительная характеристика лекарственных препаратов, применяемых для внутрибрюшной химиотерапии [24].
Так, самые высокие соотношения концентраций в брюшной полости и плазме имеют липосомальный доксорубицин и таксаны, наиболее выраженным синергизмом с гипертермией отличается мелфалан, а наибольшую глубину проникновения имеют препараты платины, что сделало их самыми распространенными цитостатиками для внутрибрюшного введения [24].
При проведении внутрибрюшной химиотерапии учитываются и такие факторы, как раствор (изотонический раствор хлорида натрия, декстроза, гипотонические растворы и коллоиды), время экспозиции, фармакологическая совместимость отдельных препаратов.
Варианты внутрибрюшной химиотерапии при раке желудка
Самым простым вариантом внутрибрюшной терапии является простое болюсное введение цитостатиков в брюшную полость путем лапароцентеза или установки порта.
В связи с ограниченной эффективностью данный метод в настоящее время редко применяется в качестве паллиативного лечения специфического асцита, а раннее послеоперационное введение цитостатиков по дренажам (EPIC, от англ.
Early Postoperative Intraperitoneal Chemotherapy) в качестве лечебного или профилактического воздействия широко применялся в 80—90-е годы прошлого столетия [25].
Среди разнообразия предложенных методов можно выделить три наиболее эффективных при лечении больных раком желудка с перитонеальным карциноматозом: 1) гипертермическую внутрибрюшную химиотерапию (HIPEC, от англ. Hyperthermic IntraPEritoneal Chemotherapy), 2) неоадъювантную внутрибрюшную и системную химиотерапию (NIPS, от англ.: Neoadjuvant Intraperitoneal and Systemic Chemotherapy) и ее периоперационный вариант — SPIC (Sequential Perioperative Intraperitoneal Chemotherapy), а также относительно новый метод паллиативной внутрибрюшной химиотерапии — внутрибрюшную аэрозольную химиотерапию под давлением (PIPAC, от англ.
: Pressurized Intraperitoneal Aerosol Chemotherapy).
Гипертермическая внутрибрюшная химиотерапия (HIPEC), лечение или профилактика
Методика HIPEC основана на комбинации двух синергичных противоопухолевых воздействий — локальной гипертермии и внутриполостного введения высоких доз цитостатиков.
Как показали исследования, локальная гипертермия помимо собственного цитотоксического действия на опухолевые клетки повышает чувствительность опухолевых клеток к цитостатикам и глубину проникновения в ткани, однако повышение температуры выше 43 °С может приводить к перфорациям кишечника и перитониту [26].
Поскольку глубина воздействия ограничена в пределах 1—3 мм, процедуру HIPEC, как правило, проводят после хирургической циторедукции, направленной на удаление макроскопически определяемых очагов болезни (СС0—СС1).
При раке желудка применение методики HIPEC имеет три основных показания: 1) профилактика перитонеального карциноматоза после радикального хирургического лечения местно-распространенных форм рака с высоким риском перитонеального рецидива (выход на серозу, поражение регионарных лимфатических узлов); 2) лечение уже имеющегося перитонеального карциноматоза в сочетании с циторедуктивной операцией; 3) симптоматическая терапия специфического асцита.
Наибольшую эффективность методика HIPEC продемонстрировала именно в качестве адъювантного метода лечения больных с резектабельным раком желудка, что обусловлено следующими причинами.
Известно, что при поражении серозной оболочки желудка свободные опухолевые клетки обнаруживаются в брюшной полости у 20—70% больных, что является предиктором перитонеального рецидива [15].
По данным разных авторов, почти у 50—58% пациентов развиваются рецидивы в виде карциноматоза [27].
Профилактическое использование HIPEC основано на предположении, что, воздействуя на свободные опухолевые клетки и эмболы сразу после выполненной гастрэктомии, можно предотвратить их имплантацию и последующий перитонеальный рецидив.В 2013 г. был опубликован метаанализ 16 рандомизированных исследований, в которых изучалась эффективность профилактического применения HIPEC после радикальной гастрэктомии [28]. В общей сложности в метаанализ включили 1062 больных. Было показано достоверное улучшение общей выживаемости в результате проведения адъювантной HIPEC (p
Источник: https://www.mediasphera.ru/issues/onkologiya-zhurnal-im-p-a-gertsena/2017/6/12305218X2017061004
Канцероматоз брюшины
Обратите внимание
Новые технологии приходят в Россию.
Приглашаем пациентов принять участие в новых методах лечения онкологических заболеваний, а также в клинических испытаниях препаратов на основе Т-клеток (LAK-терапия). Терапия проводится в различных научно-исследовательских онкологических центрах, в зависимости от вида опухоли.
Отзыв о методе министра здравоохранения РФ Скворцовой В.И.
Комментарий о клеточных технологиях главного онколога России, академика Давыдова М.И.
Патология канцероматоз брюшины характеризуется образованием вторичных множественных очагов злокачественного роста на брюшине (серозной оболочке, выстилающей изнутри брюшную полость). Канцероматоз брюшины является результатом различных инвазивных новообразований, например, лейкоза, аденокарциномы пищеварительного тракта различной локализации, лимфомы.
Чаще всего причиной канцероматоза брюшины являются различные первичные злокачественные процессы органов брюшной полости.
Из этих первичных очагов с током крови или реже лимфы бластные клетки попадают на брюшину.
Сначала образуются мелкие очаги размером с просяное зерно, затем очаги увеличиваются в размерах, склонны к слиянию, в конечном итоге образуются опухолевые узлы, значительные в своих размерах.
Метастазы спровоцированные хирургией
На поверхности органа, поврежденного злокачественным новообразованием, располагается множество раковых клеток. Именно они могут стать причиной канцероматоза брюшинной полости.
Второй вариант появления метастаз брюшной полости происходит после хирургической операции, когда злокачественные клетки легко заносятся и обсеменяют окружающие ткани и органы, часто удалить полностью опухоль просто не возможно, оставшееся хотя бы одна раковая клетка способна породить рецидив.
Требуется небольшой промежуток времени, чтобы метастатические клетки зафиксировались на поверхности брюшиной полости. Коварство кроется еще и в том, что традиционное промывание брюшной полости физиологическим раствором в данном случае не эффективно.
Современные исследования в области онкологии выявили интересную закономерность.
Установлено, что риск обсеменения злокачественными клетками увеличивается на 50-60% при проведении классической полостной операции, а при проведении лапароскопического варианта операции риск обсеменения значительно ниже (3-28%).
Клиническая картина
Симптомы при заболевании канцероматоз брюшины отмечаются у той части пациентов, у которых уже выявлена первичная опухоль либо пищеварительной системы (чаще она локализуется в кишечнике или желудке), либо инвазивное новообразование яичников у женщин. Следует отметить, что у пациенток с раковым процессом яичников вероятность возникновения канцероматоза яичников значительно выше (70%), чем у пациентов со злокачественными процессами пищеварительного тракта (только 40%).
Также на поверхности операционных швов могут формироваться метастатические очаги, которые обсеменяют брюшную полость. Клетки новообразований окружает достаточно плотный слой фибрина (от лат. fibra — волокно), который делает их практически неуязвимыми. Именно этот механизм объясняет формирование рецидива после хирургического вмешательства.
Как правильно лечить
Успешность лечения напрямую зависит от эффективности лечения первичного опухолевого очага. Результаты современных научных исследований подтверждают, что злокачественные клетки значительно более чувствительны к действию повышенной температуры.
Злокачественной клетки начинают погибать уже при температуре 44°С., а для повреждения здоровой клетки необходима значительно более высокая температура (47°С и выше).
Воздействие на опухоль высокой температурой вызывает нарушение структуры белковых молекул (денатурация белка). Синтез ДНК клетки прекращается.Кровоснабжение злокачественной опухоли претерпевает значительные изменения, опухолевые ткани становятся более проницаемым для химиотерапевтических препаратов.
Внутрибрюшинная гипертермическая химиотерапия
Именно эта методика позволяет создать достаточно высокие концентрации специфических химиомедикаментов внутри брюшной полости. С помощью подогрева раствора химиопрепарата можно в значительной степени усилить токсическое воздействие на опухолевую ткань.
Перед проведением процедуры опухолевый узел по возможности полностью или частично удаляется. В дальнейшем устанавливается система дренажных трубок, по которой осуществляется подача подогретых растворов.
Производится постоянный контроль температуры. В течение 90 минут около 12 раз порядка 7 литров раствора проходит через брюшную полость.
Используются разнообразные химиопрепараты новых поколений, а также ингибиторы ангиогенеза.
Техника
В отличие от общепринятых методик, для гипертермической внутрибрюшинной химиотерапии характерно более значительное уменьшение риска метастазирования. Метод является эффективным способом не только терапии, но и профилактики распространения бластных клеток основной опухолевого очага непосредственно внутри брюшинной полости даже у пациентов из группы высокого риска.
Эффективность методики подтверждается увеличением качества жизни пациента, значительным снижением числа послеоперационных осложнений.
• иссечение первичной опухоли, всего пораженного органа (при наличии показаний), а также очагов пораженной брюшины; • установку дренажной системы (порядка 4-6 дренажей) в определенных зонах вверху и внизу живота; • промывание антисептическими растворами на протяжении 20 минут всей полости малого таза, а также брюшной полости, таким способом удаляются кровяные сгустки; • выведение антисептического раствора из полости;
• включение системы для циркуляции растворов химиопрепаратов, которые растворены в 5% растворе глюкозы или Рингера-Локка, через термостатную установку.
Введение растворов производят через дренажные трубки, которые установлены в верхних участках брюшной полости, а выведение – через дренажные трубки в малом тазу или боковых областях. В процессе проведения сеанса необходим постоянный и тщательный контроль за равномерным распределением раствора по всей брюшной полости.
По завершению пациента переводят в отделение интенсивной терапии. Длительность лечебного процесса 5 дней. Химиорастворы рекомендуется оставлять внутри брюшной полости не более 6-12 часов. При завершении курса терапии дренажные системы удаляют.К нам поступают обращения пациентов, прошедших гипертермическую внутрибрюшиную химиотерапию и не получивших должного результата или получивших временный положительный эффект. Данную категорию пациентов приглашаем пройти лечение новыми противоопухолевыми препаратами.
Источник: http://tumor-clinic.ru/kantseromatoz-bryushiny/
Рак яичников: важно усилить химиотерапию

В России, Израиле, Германии рак яичников начинают лечить с операции. Удаляется матка с придатками, большой сальник, а также видимые проявления опухоли.
Если выполнение операции маловероятно, то начинают с химиотерапии. Это связано с тем, что рак яичников плохо отвечает на химию.
Особенно низкую эффективность химиотерапии наблюдают при муцинозном и светлоклеточном раке яичников.
Операция при раке яичников
Хирургическое вмешательство – всегда всплеск опухолевого роста и метастазирования. Опухолевые клетки механически (скальпелем) разносятся по брюшине, попадают в кровоток. От избытка кислорода раковые клетки активизируются. Это чревато рецидивом и метастазами.
Если злокачественную опухоль до операции задавить химиотерапией, то это снизит активность клеток к росту и метастазированию, увеличит радикальность операции.
Операции при раке яичника в “К-тест”
Простое введение химиопрепаратов малоэффективно. Поэтому в клинике “К-тест” химиотерапию усиливают, вводя препараты под нагревом методом общей электромагнитной гипертермии. В конечном счете предоперационная терапия по данной схеме улучшает результаты и выживаемость.
Общая гипертермия – перспективный метод лечения онкологии, который исследуется более полувека. Ученые разных стран пробуют возможные способы нагрева (в воде, в специальных камерах и т.д.).
Разработками советских ученых в 80-х годах был предложен нагрев в электромагнитных полях. Нижегородские медики и физики объединились и была разработана и апробирована общая электромагнитная гипертермия. Ведущим онкологом этих исследований был профессор Карев.
Сейчас он возглавляет клинику “К-тест”. Установки общей электромагнитной гипертермии в постперестроечный период не получили распространения в стране. Причина – высокая стоимость и сложность процедуры. В Нижнем Новгороде как начали лечить, так и лечат более 25 лет.
Более простая и дешевая локальная гипертермия используется в ведущих онкоцентрах страны.
Если после 2-3 курсов проводимой химиотерапии в рамках стандартного лечения по ОМС нет заметной положительной динамики, улучшения самочувствия, уменьшения размеров опухоли и метастазов, то следует задуматься о необходимости усиления химиотерапии нагревом. Дальнейшее продолжение стандартной химиотерапии при отсутствии динамики, даже со сменой химиопрепаратов, приведет только к устойчивости рака яичников к лекарствам.
Лечение рака яичников после операции
После операции рекомендована курсовая общая электромагнитная гипертермия с химиотерапией. Для окончательного подавления опухоли и клеток, которые разнеслись по организму в ходе операции.
Введение химиопрепаратов на фоне разогрева тела до температуры гибели опухолевых клеток (42,5 °С и выше) решает проблему устойчивости опухоли к препаратам платины. Также до минимума снижает риск рецидивов.
Число курсов и выбор химиопрепаратов зависит от гистологической классификации опухоли и степени рака. С целью улучшения результата лечения может назначаться таргетная терапия (бевацизумаб).
Рецидив рака яичников можно остановить
Когда к нам обращались пациентки с прогрессированием опухоли яичников после химиотерапии первой линии (платинорефрактерный рак), введение этих же препаратов в условиях общей гипертермии давало ощутимый эффект: опухоль и метастазы уменьшалась уже после первого курса.
Такая картина наблюдалась даже у больных, которые до поступления к нам уже получали множество курсов химиотерапии второй и третьей линий (до 30 курсов) и их переводили на симптоматическую терапию.
Клинический пример:
Больная П., 44 года. Диагноз: Ракяичников T3cNoMo
В 2014 году больная в Екатеринбургеполучала комбинированное лечение (экстирпация матки с придатками + адъювантнаяхимиотерапия). Гистология и иммуногистохимия – аденокарцинома, метастазы вбольшой сальник. В январе 2019 года выявлен асцит. На ПЭТ КТ от 17.01.19 –рецидив опухоли в малом тазу.
Проведена химиотерапия – 4 курса. На ПЭТ/КТ от5.07.2019 выявлена отрицательная динамика – появились уплотнения и инфильтрация(канцероматоз) брюшины (SUV max7.26), жидкость в малом тазу и брюшной полости. В надключичной областилимфоузлы 9х6 мм (SUV max 1,83). Субплеврально – очаг (SUV max 1,90).В сентябре 2019 года обратилась в клинику «К-тест», где проведены 2 курса, включающие общую гипертермию с температурой 42,8 градуса Цельсия + химиотерапия (паклитаксел и карбоплатин). На контрольной ПЭТ/КТ от 30.10.
2019 года канцероматоз не определяется, асцита нет, очагов метаболической активности в брюшной полости и малом тазу не обнаружено. Существенное уменьшение размеров и регрессия активности в надключичных лимфоузлах.
Регрессия участка воспаления в легком. Больная продолжает лечение.
Рак яичников 4 стадии
При запущенном раке яичников в клинике «К-тест» лечение направлено как на облегчение симптомов проявления болезни, так и на подавление роста опухоли и метастазов.
Применяемая схема позволяет добиться пятилетней выживаемости у 15-20 % пациенток с запущенным и рецидивирующим раком.
При платинорефрактерном раке яичников или рецидиве заболевания переход на химиотерапию в условиях нагрева предпочтительнее, чем химиотерапия второй или третьей линии, которая зачастую не увеличивает продолжительность жизни и ухудшает ее качество в связи с возникновением побочных эффектов.
Хорошие результаты при лечении внутрибрюшинных и отдаленных метастазов рака яичника в легкие и печень.
Под действием критической температуры происходит их резорбция. Становится возможно выполнение метастазэктомии (удаление крупных метастазов).
Лечебное действие электромагнитной гипертермии наряду с противоопухолевым эффектом снимает боли, стимулирует иммунитет, улучшает качество жизни больных.
Еще клинический пример:
РАК ЛЕВОГО ЯИЧНИКА T4N3M0
Сравнение схем лечения по стандарту ОМС и в клинике “К-тест”:
Источник: https://www.k-test.ru/%D1%80%D0%B0%D0%BA-%D1%8F%D0%B8%D1%87%D0%BD%D0%B8%D0%BA%D0%B0-%D0%BB%D0%B5%D1%87%D0%B5%D0%BD%D0%B8%D0%B5-%D0%BF%D1%80%D0%BE%D0%B3%D0%BD%D0%BE%D0%B7/
