Расшифровка анализа полиморфизмов
Для мутантов:) Расшифровка значения полиморфизма генов — полиморфизм гена асе

Сама долго рылась — искала, чтоб по-русски было объяснено, какой ген, что означает. Вот, может, кому еще пригодится: что означают полиморфизмы генов
Генетические факторы риска привычного невынашивания беременности
Комплекс исследования — Генетические факторы риска привычного невынашивания беременности включает в себя анализ на:
- полиморфизм G20210А гена II фактора свертываемости крови ( протромбина)
- полиморфизм G1691А гена V фактора свертываемости крови (лейденского фактора)
- полиморфизм С667Т гена метилентетрагидрофолатредуктазы ( МТНFR)
- полиморфизм 4 G/5 G гена ингибитора активатора плазминогена ( РАI-1)
- полиморфизм VaI34Leu гена фактора XIII свертываемости крови (F13)
- полиморфизм D/I гена ангиотензинпревращающего фермента ( АСЕ)
- полиморфизм А1/А2 гена CYP17 **
Привычное невынашивание беременности тесно связано с генетическими нарушениями. Риск невынашивания складывается из нескольких составляющих:
- Нарушение тромбообразования.
- Нарушение тромболизиса.
- Нарушении синтеза половых гормонов.
При повышенной склонности к тромбообразованию, нарушается система гемостаза. Генетические нарушения у женщин с наследственной тромбофилией проявляются при беременности. Предрасположенность к тромбофилии является причиной привычного невынашивания, задержки развития плода, гестозов, нарушения развития плаценты.
Генетические факторы риска
Замедление процессов фибринолиза при мутации генов PAI -1 является причиной нарушения процесса имплантации плода.
Мутация 6754/5G приводит к повышению фибрина в сосудах матки, снижению плацентарного кровообращения, что в свою очередь является причиной задержки развития плода.
Полиморфизм гена MTHFR, который является ферментом метаболизма продукта гомоцистеина. В норме это вещество не накапливается, при генетическом нарушении оно поражает сосуды и способствует образованию тромбов.
Полиморфизм гена F5 который отвечает за антикоагуляционные реакции, приводит к осложнениям беременности, невынашиванию, отставанию развития плода, поздним выкидышам, образованию тромбов в плаценте.
Мутация гена F2, который отвечает за образование протромбина, участвующего в свертывании крови, приводит к повышению его уровня в два раза. Полиморфизм этого гена является фактором всех осложнений беременности.
Ген F 13 отвечает за образование фибриназы. При мутации этого гена повышается активность фибриназы при нормальном ее количестве.
При полиморфизме гена АСЕ, отвечающего за повышение артериального давления, приводит к развитию одного из самых опасных осложнений беременности — эклампсии.
Изменения гена CYP17, отвечающего за образование стероидных гормонов, при генотипе А2/А2 и А1/А2 значительно увеличивает риск невынашивания.
Полиморфизм гена АСЕ
Ген АСЕ участвует в превращении неактивного ангиотензина в активный. Это вещество является одним из самых активных веществ, которые повышают артериальное давление. В связи с этим могут развиваться артериальные гипертензии, эндотелиальная дисфункция, тяжелое осложнение у беременных — эклампсия.
Полиморфизм коагуляционного фактора F5 (V)
Фактор играет важную роль в регуляции свертываемости крови — образование тромбина. Мутация G1691A (мутация Лейден) приводит к гиперкоагуляции и к риску развития образования тромбов в венозных сосудах, артериальным тромбоэмболиям. Полиморфизм гена повышает риск развития коронарного стеноза, инфаркта миокарда и инсульта.
Полиморфизм коагуляционного фактора F2 (20210 G)
Коагуляционный фактор F2 (протромбин) участвует в процессах свертываемости крови (образованию кровяных сгустков). Полиморфизм 20210 G приводит к увеличению протромбина в два раза. Повышается риск возникновения тромбофилии, сердечно-сосудистым заболеваниям.
Полиморфизм гена MTHFR (С677Т)
Факторотвечает за синтез фолиевой кислоты, а также является ферментом метаболизма гомоцистеина, который токсически действует на сосуды. Накопление гомоцистеина приводит к коронарному атеросклерозу. Мутация гена приводит к ишемическим заболеваниям сердца, инфаркту миокарда, атеросклерозу, осложнениям беременности, дефектам развития плода.
Полиморфизм коагуляционного фактора F7 (Arg353Gln)
Фактор активирует систему свертывания крови образованию кровяного сгустка. Высокий уровень F7 повышает риск стеноза коронарных сосудов и инфаркта миокарда.
Полиморфизм тромбоцитарного рецептора фибриногена
Фактор обеспечивает быстрое склеивание тромбоцитов и купирование поврежденного эпителия. Мутация гена приводит к повышенной агрегации тромбоцитов и образованию тромбов, что приводит к сердечно-сосудистым заболеваниям. Терапия аспирином у пациентов с мутацией данного фактора не эффективна.
Полиморфизм A фибриногена (455 G)
Фибриноген при повреждении сосудов переходит в фибрин и образует кровяные сгустки. Мутация может привести к повышенной выработке фибриногена в крови и создает высокий риск образования тромбов. Это приводит к повышенному давлению крови, инсультам и тромбоэмболическим заболеваниям. Риск инсультов при этом может увеличиться в 4 раза.Источник тут
Е
сли забить в поисковик на этом сайте «полиморфизм», то там выскакивает много ссылок про еще разные гены, если кому-то этих не хватит))) вкратце и по-русски.
Источник: https://www.BabyBlog.ru/community/post/conception/3074125
Анализы на тромбофилию

Чтобы обнаружить генетическую предрасположенность (ГП) к тромбообразованию пациентам, назначаются анализы на тромбофилию.
Практическое значение лабораторных методов очень важно — они позволяют выяснить причины нарушения свертываемости крови, спрогнозировать развитие тромботических осложнений и тем самым уменьшить частоту наиболее распространенных заболеваний, таких как тромбоз, тромбофлебит, легочная эмболия и др.
Особенно важно своевременное выявление тромбофилии при беременности. Зная диагноз пациентки, врач сможет обеспечить ей грамотное медицинское сопровождение до самых родов.
Причины и симптомы
Основной причиной заболевания является недостаточность регуляторных механизмов, ограничивающих образование сгустков крови.
Кровяные сгустки формируются при свертывании крови для восстановления поврежденных сосудов в результате биохимических реакций между специальными клетками (тромбоцитами) и белками (факторами свертываемости), которые ответственны за регуляцию процессов гемореологии и гемостаза. При расстройстве этих процессов тромбы начинают образовываться без видимой причины и блокировать приток крови к окружающим тканям. Такая тенденция к повышенному образованию сгустков крови называется гематогенная тромбофилия.
Если у пациента выявлена тромбофилия, то клинические проявления будут зависеть от места нахождения сгустков, степени нарушения кровообращения, сопутствующей патологии, возраста и пола пациента.
Основной симптом — это частое образование тромбов, болезненность в месте их локализации, нарастающая отечность.Развитие заболевания могут спровоцировать генетические и экологические факторы, поэтому тромбофильные аномалии подразделяются на наследственные и приобретенные.
Наследственная тромбофилия
Генетический дефект обуславливает образование большого количества кровяных сгустков у молодых людей.
Основные признаки — возникновение множественных тромбозов у относительно молодых людей без видимых причин.
Наследственная тромбофилия обусловлена генетическими дефектами, которые присутствуют с самого рождения. Наибольшая предрасположенность к врожденной форме появляется, когда оба родителя — носители дефектных генов.
Чаще всего встречаются следующие аномалии:
- дефицит антитромбина III и белка C и S, которые отвечают за повышенное образование сгустков;
- фактор V Лейден, препятствующий свободному кровотоку.
Приобретенная тромбофилия
Встречается в старшем возрасте и возникает в результате аутоиммунных расстройств, гормональных дисбалансов и заболеваний, которые приводят к уменьшению кровотока через вены и артерии. Аномальная свертываемость может появиться после серьезных операций, катетеризации сосудов, длительной иммобилизации, при беременности и употреблении гормональных оральных контрацептивов.
Когда необходимы тесты?
Обследование и анализ на генетическую тромбофилию необходимо сделать при таких обстоятельствах, как:
Если беременность протекает с осложнениями, то женщине нужно дополнительное обследование.
- повторный тромбоз;
- единичный или множественный тромбоз в сравнительно молодом возрасте;
- планирование беременности;
- возникшие осложнения при вынашивании ребенка;
- онкологические и системные недуги;
- последствия сложных операций, тяжелых ранений, инфекций.
Какие анализы проводятся?
Для исследования берется венозная кровь, которая содержит генетические маркеры тромбофилии, информацию о составе, вязкости, свертываемости. Для этого пациенту проводится коагулограмма — базовый анализ крови на тромбофилию, позволяющий диагностировать проблемы с гемостазом и гемореологией. Он включает определение таких параметров, как:
- время свертывания крови;
- АЧТВ;
- протромбиновый индекс;
- тромбированное время;
- концентрация фибриногена;
- фибринолитическая активность;
- активированное время рекальцификации;
- период лизиса (растворения) эуглобулинового сгустка;
- активность антитромбинов;
- факторы свертывания;
- Д-димер и др.
Чтобы выявить генную мутацию, необходимо дополнительно обследоваться.
Отдельное обследование назначают при подозрении на генетическую мутацию, чтобы выявить полиморфизм генов и подтвердить врожденную предрасположенность к заболеванию. Для этого необходимо выполнение специфических анализов.
Определение формы генетических особенностей дает возможность выбрать тактику лечения для пациентов, у которых обнаружилась генная мутация.
Анализ на наследственную тромбофилию включает обнаружение наиболее часто наследуемых полиморфизмов:
- гены свертывания крови — F2, фактор V-Лейден, F7, F13 и др;
- мутация антитромбина 3;
- дефицит протеинов С и S;
- ген MTHFR;
- ген ингибитора активатора плазминогена PAI-1 4G/5G и др.
Анализы можно сдать в лабораториях, где имеются все условия для изучения материала. В крупных медицинских центрах патология диагностируется с помощью специальной тест-системы «Кардиогенетика тромбофилии».
При планировании беременности проводят скрининг-тесты. Основное требование к подготовке — воздержание от пищи в течение 8 часов перед анализом.
Иногда необходима дифференциальная диагностика, чтобы отличить заболевание от гемофилии.
Расшифровка анализа, нормы и отклонения
Полиморфизм генов не является непременным критерием развития заболевания, но обуславливает больший риск его развития, особенно при воздействии различных внешних факторов.
Исследование может дать положительный результат.
Генотип полиморфизма у пациента может быть представлен такими вариантами:
- GG — норма;
- А/А — гомозигота;
- G/А — гетерозигота.
Результаты анализа на тромбофилию указывают на присутствие или отсутствие мутации. Исследование крови может показать следующие результаты:
- Мутаций не выявлено.
- Гомозиготная — указывает на присутствие двух генов с измененной структурой, поэтому вероятность проявления заболевания высокая.
- Гетерозиготная. Означает, что пациент — носитель одного измененного гена, и вероятность заболевания невысокая.
Расшифровка анализа по полиморфизму генов показана в таблице:
| Уровень фибриногена | G\G | G\A | A\A |
| F13 | G\T | T\T | |
| Фактор V-Лейдена | G\A | A\A | |
| F2 | |||
| Ингибитор активатора плазминогена | 5G/5G | 4G/5G | 4G/4G |
Оценивать данные, полученные в ходе исследования крови, должен профильный врач.
На основании этих данных формируется заключение прогностического характера о генетической предрасположенности человека к развитию тромбофилии и о степени риска появления тромбоза.
При исследовании крови в лаборатории используются различные методики, поэтому показатели могут немного отличаться. Оценка результатов должна проводиться в соответствии с нормативами отдельной лаборатории врачом-гематологом.
Норма отдельных показателей коагулораммы крови показана в таблице:
| Протромбированный индекс | 72—120% |
| Тромбированное время | 11—18 секунд |
| Свертывание | 5—10 минут |
| Активированное время рекальцификации | 50 -70 мин. |
| Антитромбин 3 | 72—126% |
| D-димер | 250—500 нг/мл |
| Фибриноген В | Негативный |
| Тромботест | IV-V степень |
Источник: https://EtoVarikoz.ru/tromboobrazovanie/innoe/analiz-na-trombofiliyu.html
Фолатный цикл. Исследование полиморфизмов в генах: MTHFR (A222V, C>T), MTHFR (E429A, A>C), MTR (D919G, A>G), MTRR (I22M, A>G), SLC19A1 (H27R, A>G)
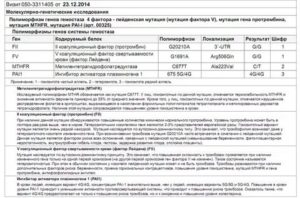
array(20) { [«catalog_code»]=> string(6) «180016» [«name»]=> string(189) «Фолатный цикл. Исследование полиморфизмов в генах: MTHFR (A222V, C>T), MTHFR (E429A, A>C), MTR (D919G, A>G), MTRR (I22M, A>G), SLC19A1 (H27R, A>G)» [«period»]=> string(1) «5» [«period_max»]=> string(2) «12» [«period_unit_name»]=> string(6) «к.д.
» [«cito_period»]=> NULL [«cito_period_max»]=> NULL [«cito_period_unit_name»]=> NULL [«group_id»]=> string(6) «392581» [«id»]=> string(4) «3071» [«url»]=> string(56) «folatnyj-cikl-issledovanije-polimorfizmov-v-genah_180016» [«podgotoa»]=> string(136) «
Не менее 3 часов после последнего приема пищи. Можно пить воду без газа.
» [«opisanie»]=> string(10991) «
Метод исследования: Определение нуклеотидной последовательности соответствующих генетических локусов методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Исследование полиморфизмов в генах:
- MTHFR (метилентетрагидрофолатредуктаза, A222V, C>T), rs1801133
- MTHFR (метилентетрагидрофолатредуктаза, E429A , A>C), rs1801131
- MTR (метионинсинтаза, D919G, A>G), rs1805087
- MTRR (метионинсинтазаредуктаза, I22M, A>G), rs1801394
- SLC19A1 (транспортер фолатов, H27R, A>G), rs1051266
В данной панели исследуются факторы свертывающей системы крови, ассоциированные с дефектами ферментов фолатного цикла, которые в свою очередь влияют на состояние стенок сосудов, впоследствии приводящие к тромбофлебическим состояниям.
Генетические дефекты ферментов фолатного цикла (MTHFR, MTR, MTRR) особенно в сочетании с дефицитом в организме фолиевой кислоты и витаминов В6 и В12 приводят к нарушению фолатного цикла, что в свою очередь влечет за собой накопление гомоцистеина в клетках и повышение его уровня в плазме.
Гомоцистеин обладает тромбофилическим действием, а также выраженным токсическим и атерогенным действием, что повышает риск развития ряда патологических процессов, таких как усиление побочных эффектов при проведении химиотерапии и повышение риска возникновения сердечнососудистых заболеваний (ишемическая болезнь сердца, инфаркт миокарда, атеросклероз, венозные тромбозы).
Дефицит в организме витаминов В6 и В12 усиливает негативный эффект полиморфизмов в генах фолатного цикла.
Ген SLC19A1 является транспортером фолатов. Участвует также в поддержании внутриклеточной концентрации фолатов. Мутации в этом гене связаны с дефектами нервной трубки и расщелиной губы и/или неба у плода во время беременности. Мутации в гене влияют на возникновение побочных эффектов при терапии метотрексатом.
Определение нуклеотидной последовательности соответствующих генетических локусов проводится методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Преимущества метода:
- высокая прогностическая значимость выявляемых факторов риска;
- точность определения генотипа;
- анализ на наличие мутаций достаточно провести 1 раз в жизни.
Показания к исследованию:
- Гипергомоцистеинемия (повышенный уровень гомоцистеина в крови);
- Планирование беременности;
- Невынашивание беременности, гибель плода во 2 и 3 триместрах беременности;
- Рождение ребенка с изолированными пороками нервной трубки, сердца или урогенитального тракта;
- Ишемическая болезнь сердца, артериальная гипертензия, атеросклероз, венозный тромбоз;
- Тромбоэмболии;
- Антифосфолипидный синдром;
- Семейная предрасположенность к онкологическим заболеваниям;
- Назначение химиотерапии;
- Назначение оральных контрацептивов и гормональной заместительной терапии.
Интерпретация результатов:
Для каждого полиморфизма в бланке ответа в графе «Результат» указывается его аллельное состояние: «Гетерозигота» или «Гомозигота».
Пример результата исследования. Выявление полиморфизмов в генах, связанных с фолатным циклом
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, A222V, C>T), rs1801133 | CT |
| Полиморфизм в гене MTHFR (метилентетрагидрофолатредуктаза, E429A , A>C), rs1801131 | AC |
| Полиморфизм в гене MTR (метионинсинтаза, D919G, A>G), rs1805087 | AG |
| Полиморфизм в гене MTRR (метионинсинтазаредуктаза, I22M, A>G), rs1801394 | AG |
| Полиморфизм в гене SLC19A1 (транспортер фолатов, H27R, A>G), rs1051266 | AA |
Источник: https://www.cmd-online.ru/analizy-i-tseny/folatnyj-cikl-issledovanije-polimorfizmov-v-genah_180016/
Мутации генов гемостаза MTHFR – что это значит и что с этим делать

Мутация гена MTHFR является проблемой, связанной с плохим метилированием и продукцией ферментов. Мутации генов гемостаза MTHFR влияют на каждого человека по-разному. Иногда они приводят к едва заметным симптомам, а иногда приводят к серьезным, долговременным проблемам со здоровьем.
Хотя точный показатель распространенности все еще остается предметом дискуссий, считается, что 30%-50% всех людей могут иметь мутацию в гене MTHFR, который наследуется и передается от родителя к ребенку.
Как правило, это гетерозиготная мутация. Приблизительно от 14% до 20% процентов населения могут иметь более тяжелую мутацию MTHFR, которая более резко влияет на общее состояние здоровья.
Она называется гомозиготной мутацией.
Разница состоит в том, что гетерозигота – это мутация в одной аллели пары генов. То есть шанс ее проявления составляет 50%. А гомозигота – мутация в обеих аллелях пары генов, проявление в 100% случаев.
Мутация гена MTHFR была обнаружена во время завершения проекта генома человека. Исследователи поняли, что люди с этим типом наследственной мутации имели большую вероятность развития определенных заболеваний. К ним относятся: СДВГ, болезнь Альцгеймера, атеросклероз, аутоиммунные расстройства и аутизм.
Еще многое предстоит узнать о том, что означает этот тип мутации для людей, которые несут ее и продолжают передавать своим детям.На сегодняшний день существуют десятки различных состояний здоровья, связанных с мутациями MTHFR. Но еще раз подчеркнем, что даже если вы являетесь носителем мутации – не факт, что у вас будут ее проявления. Мутация означает лишь повышение рисков.
Что такое мутация генов MTHFR
MTHFR — это ген, который обеспечивает организм инструкциями по производству определенного фермента, называемого метилентетрагидрофолатредуктаза . То есть MTHFR — сокращенное название этого фермента.
Есть две основные мутации MTHFR, на которых исследователи фокусируются чаще всего. Эти мутации часто называют «полиморфизмами» и влияют на гены, называемые MTHFR C677T и MTHFR A1298C.
Также эти мутации называют – мутациями фолатного цикла, потому что они показывают, как организм преобразует фолиевую кислоту в активную форму для наилучшего усвоения.
Соответственно, если у вас есть мутации генов гемостаза MTHFR, то ваш организм плохо усваивает фолиевую кислоту и другие витамины группы B, особенно В12. Что делать в этом случае – читайте далее.
Мутации могут происходить в разных местах этих генов и наследоваться только от одного или обоих родителей. Наличие одного мутантного аллеля связано с повышенным риском определенных проблем со здоровьем, но наличие двух увеличивает риск намного больше.
Мутация гена MTHFR может изменить способ, которым некоторые люди метаболизируют и преобразовывают важные питательные вещества из своего рациона в активные витамины, минералы и белки.
Генетические мутации также могут изменять уровни нейротрансмиттеров и гормонов.
В некоторых случаях, хотя и не во всех, изменения в работе этого фермента могут влиять на параметры здоровья, включая уровень холестерина, функцию мозга, пищеварение, эндокринные функции и многое другое.
Часть о мутациях генов гемостаза MTHFR впервые узнают после анализа причин замершей беременности
1. Потребляйте больше натурального фолата, витамина В6 и витамина В12
В случае с мутациями генов фолатного цикла важно употреблять много продуктов, богатых витаминами B6, B9 и B12.
Вы также можете принимать их в виде добавки. Однако, помните, что людям с мутациями MTHFR труднее переводить синтетическую форму фолиевой кислоты в биодоступную. Более того, прием обычной фолиевой кислоты может вызвать ухудшение симптомов.
Получение достаточного количества фолиевой кислоты особенно важно до и во время беременности. За три месяца до зачатия и в течение первого триместра беременности матери, которые получают достаточно фолиевой кислоты, снижают риск развития у детей различных проблем со здоровьем.
Людям с мутациями MTHFR критически важно получать биодоступные формы фолата в добавках, называемых L-метилфолатом или метильной формой витамина В9.
L-метилфолат сложнее упаковывать в форме капсул, поэтому вы, возможно, не сможете получать очень высокие дозы в типичных поливитаминах или добавках. Поэтому рекомендуется принимать моно-добавки под называнием 5-MTHF.Now Foods, Метилфолат, 5000 мкг, 50 вегетарианских капсул
Thorne Research, 5-МТГФ, 5 мг, 60 капсул
Если у вас обнаружена мутация MTHFR в форме гомозиготы, то метильные комплексы фолиевой кислоты вам необходимо пропивать постоянно курсами — минимум 3 раза в год.
Наличие большего количества фолиевой кислоты в вашем рационе означает, что вы лучше способны создавать активную форму 5-MTHF. Некоторые из лучших продуктов с высоким содержанием фолиевой кислоты включают в себя:
- Фасоль и чечевица
- Листовые зеленые овощи, такие как сырой шпинат
- Спаржа
- Ромэн
- Брокколи
- Авокадо
- Яркие фрукты, такие как апельсины и манго
Источник: https://blisswoman.ru/shemy/mutatsii-genov-gemostaza-mthfr-chto-eto-znachit-i-chto-delat/
Генетические анализы при потерях беременности
Aнализы на генетические полиморфизмы при выкидышах и замерших беременностях в первом триместре
Поскольку 80%[1] потерь приходятся на первые три месяца беременности, только этих ситуаций мы коснемся в статье. Причины потери беременности после 12 недель – предмет отдельного обсуждения.
Непросто поверить, но риск спонтанного прерывания беременности на сроке 6-12 недель у здоровой женщины моложе 35 лет составляет не менее 10%[2], и повлиять на причины этих событий можно в меньшинстве случаев.
Итак, женщина понимает: ребенка не будет. Одно из первых желаний в такие моменты – узнать причину. И находятся желающие эту потребность удовлетворить: ошарашенной женщине назначают многочисленные обследования и анализы, и редко обходится без тестов на:
- «генетические причины потери беременности»
- «полиморфизмы в генах гемостаза и фолатного цикла»
- «мутации предрасположенности к невынашиванию беременности»
- «генетический риск осложнений беременности»
- …
Вариантов названий у этой услуги множество. Суть одна: по материалу матери определяют ее генотип по полиморфизмам нескольких генов.
Когда женщине назначают «генетические анализы» по поводу потери беременности — это в 99% случаев именно анализы на полиморфизмы. Поэтому (с определенным допущением) можно сказать, что анализы на полиморфизмы = генетические анализы, которые назначаются женщинам по поводу потери беременности.
| Непросто в двух словах рассказать, что такое полиморфизмы. Полиморфизмы – это незначительные различия в структуре генов, определяющие разнообразие их проявлений. Каждый конкретный полиморфизм «живёт» в определенном гене, немножко изменяя свойства его продукта и, тем самым, проявление какого-то признака.Полиморфизмы – это то, что делает нас разными. Это генетические оттенки, из-за которых один может за милую душу выпить литр молока, а другой после пары глотков будет искать туалет. Благодаря полиморфизмам у нас столько цветов глаз и волос. Из-за них у кого-то кровь сворачивается чуть быстрее среднего, а у кого-то – чуть медленнее. Удивительно, но весь этот спектр форм, цветов и особенностей задается комбинациями четырех букв-нуклеотидов, составляющих наши гены: A, G, T и C. Одну букву мы получаем от мамы, другую – от папы. Так получается наш собственный генотип: например GG, GA или TC. Результатом анализа на полиморфизмы как раз и будут пары букв.Например, в гене фактора свертывания крови V (этот ген называется F5) буквой под номером 1691 может быть G, а может – А. Отсюда три варианта генотипов: GG, GA и AA. Вариант GG — удел большинства людей, ему не свойственны какие-то особенности. Около 2-7% людей имеют генотип GА, то есть несут полиморфизм А (так называемую Лейденскую мутацию), из-за чего склонны к повышенной свертываемости крови. Людей с генотипом АА крайне мало.Грань между понятием «мутация» и «полиморфизм» тонка и неопределенна. Ученые-биологи любое отклонение от «эталона» могут называть мутацией, а врачи-практики обычно считают мутацией только то изменение, которое может приводить к болезни. Поэтому не смущайтесь, что полиморфизм в гене F5 называют Лейденской мутацией. |
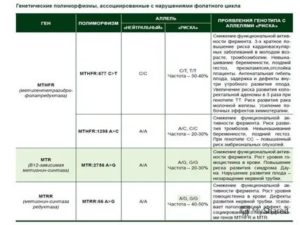
Какие полиморфизмы обычно обсуждаются в контексте потери беременности?
Назовём героев этой статьи поимённо!
Не пугайтесь того, что эти названия вам ни о чем не говорят, и пока что поверьте: они и врачу вашему в большинстве случаев ничего не скажут.
- F5: 1691 G>A (Arg506Gln)NB!
- F2: 20210 G>A NB!
- F7: 10976 G>A (Arg353Gln)
- F13: G>T (Val34Leu)
- FGB: -455 G>A
- ITGA2: 807 C>T (Phe224Phe)
- ITGB3: 1565 T>C (Leu33Pro)
- SERPINE1 (PAI-1): -675 5G>4G
- MTHFR: 677 C>T (Ala222Val)
- MTHFR: 1298 A>C (Glu429Ala)
- MTR: 2756 A>G (Asp919Gly)
- MTRR: 66 A>G (lle22Met)
NB! Обратите внимание, что эти два полиморфизма могут играть важную роль в принятии решения о назначении КОК (комбинированных оральных контрацептивов).
Почему врачи назначают анализы на эти полиморфизмы?
Когда ученые узнали о существовании полиморфизмов, они задумались: а нельзя ли использовать это знание для выделения группы людей с предрасположенностью к определенным заболеваниям, и заблаговременно их предупреждать? Известно же: предупредить легче, чем лечить!
Эти времена совпали с подъемом молекулярных технологий, позволивших выполнять тесты на полиморфизмы относительно просто и недорого. Исследователи смекнули, что работы типа «Влияние полиморфизма Х на болезнь Y» генерировать легко и делать это можно практически бесконечно.
Поскольку болезней и полиморфизмов много, всегда была возможность подобрать пару «полиморфизм – болезнь», позволявшую даже из безнадежных данных вытащить мало-мальски значимую связь и опубликоваться, кокетливо умолчав об изъянах дизайна исследования.
Соедините немного логики и статистики – и получите скромное, но научное достижение.
Вот как рассуждали эти исследователи: уже упоминавшаяся Лейденская мутация связана с повышенной свертываемостью крови. Известно, что формирование и функционирование плаценты сильно зависит от агрегатных свойств крови, а при невынашивании беременности в плацентах нередко находят очаги тромбоза.
Логично предположить, что у носительниц Лейденской мутации эти нарушения могут встречаться чаще. Осталось провести исследование и проверить эту гипотезу. Такие исследования были проведены и некоторые показали наличие связи между наличием Лейденской мутации и повышенным риском потери беременности.
Так появилась богатая (на немалую долю отечественная) «литературная база», указывающая на связь между полиморфизмами и предрасположенностью к разным болезням.
Именно на эту «базу» опирались производители реагентов при убеждении врачей в целесообразности назначения тестов на полиморфизмы.
Да-да, на определенном этапе потребность в диагностикумах для анализов на полиморфизмы стала так велика, что привлекла производителей реагентов, которые создали коммерческие наборы для выполнения этих тестов. А товар требует продвижения.
Как можно расширить рынок таких наборов? Внедрить тесты на полиморфизмы в клиническую практику! И эти анализы из научных лабораторий стали «заползать» в диагностические.
Когда результаты научных исследований переносятся в клиническую практику без должной оценки последствий, страдают кошельки и нервы пациентов.Так появились лаборатории, предлагающие тесты на полиморфизмы как медицинские диагностические услуги. Так появились врачи, наученные лабораториями и производителями реагентов, что эти тесты нужно назначать в различных случаях, в том числе при невынашивании беременности. Так сформировалась целая мифология про то, какие полиморфизмы надо выявлять и как их «лечить».
1. Полиморфизмы не являются значимой причиной ранней потери беременности
Около 70% беременностей, прервавшихся в первом триместре, не могли развиваться из-за генетических аномалий ЭМБРИОНА (не матери!!!)[3]. Не путайте с генетическими полиморфизмами!
Полиморфизмы – это генетические особенности мамы, а приводящие к выкидышу нарушения структуры и количества хромосом – это грубые аномалии эмбриона. Возникновение таких эмбрионов – часть жизни, так же, как и их ранняя отбраковка.
Оставшиеся 30% ранних потерь беременности тоже не имеют отношения к полиморфизмам, а обусловлены антифосфолипидным синдромом, неправильным функционированием шейки матки, инфекциями и другими причинами, к которым генетические полиморфизмы матери не относятся.
2. Какие-то полиморфизмы есть у всех людей
В отличие от мутаций, вызывающих редкие генетические болезни, которые встречаются у одного из десятков тысяч людей, какие-то полиморфизмы есть у всех. Каждый день мимо вас проходят люди с такими же GG, GA и TC, как у вас.
Возможно, у них есть дети, но может быть и нет. Есть вероятность, что они сталкивались с потерей беременности, а может быть их это несчастье обошло стороной.
В любом случае: от вас они отличаются тем, что не тратили деньги на анализ полиморфизмов.
3. Полиморфизмы не определяют признак полностью (или на большую часть)
Вернемся к несчастным больным генетическими заболеваниями: их редкий генетический дефект практически на 100% определяет их беду. То, что генетики называют «факторами среды» (поведение, питание, физическая активность) вносит очень маленький вклад в их несчастье. С полиморфизмами наоборот: их вклад очень мал.
Например, вероятность развития венозного тромбоза хоть в некоторой степени и зависит от наличия, например, уже знакомой нам Лейденской мутации, но на львиную долю определяется весом, статусом курения, возрастом, наличием беременности, принимаемыми препаратами и другими факторами.
4. Полиморфизм – не болезнь
Какими бы жуткими словами не сопровождались комбинации из букв A, G, T и C в заключении генетического анализа, они НЕ говорят о том, что у женщины будет, например, «невынашивание беременности».
Пример из жизни:
Когда на бланке результата «Нарушение развития плода – незаращение нервной трубки» написано рядом с «MTRR c.66A>G G/G» любой человек поймёт такую запись как причинно-следственную связь. А это не так.
Наличие полиморфизмов говорит лишь о том, что вы принадлежите к людям, у которых по данным некоторых(!) научных(!!!) исследований эти патологии возникают чаще, чем у людей без ваших полиморфизмов.
И тут мы переходим к следующему факту…
5. Влияние полиморфизмов «видно» только на больших группах людей
Даже будучи специалистом, я не пойму ваш генотип по генам свертывания крови, увидев вашу коагулограмму (анализ на свертываемость крови). А всё потому, что эти различия не «видны» на индивидуальном уровне.
У человека с «плохими» полиморфизмами свертывание может быть «лучше», чем у «генетически идеального».
Лишь среднее значение этого показателя, измеренное в большой группе людей с «плохим» генотипом, будет отличаться от такового у группы с «хорошим».
| Немного математики: Иногда в заключении анализа рядом с жуткими «диагнозами» можно увидеть цифры. Например, «Выявленный полиморфизм в 3,5…5,5 раз увеличивает риск венозной тромбоэмболии». Эти цифры – совершенно честные[4] для Лейденской мутации. Этот полиморфизм – один из двух достойных хоть какого-то внимания полиморфизмов системы свертывания крови. Второй – так называемый «полиморфизм протромбина», c.20210G>A в гене фактора свертывания крови II (F2).Но вернемся к цифрам. Увеличение в 3,5…5,5 раз – это существенно? Конечно существенно! Если мне завтра в три с половиной раза увеличат зарплату, это будет ой как существенно…А если посмотреть не относительный, а абсолютный риск? Когда у вас есть Лейденская мутация, ваш ежегодный риск получить венозную тромбоэмболию равен 0,05…0,2%. Иными словами:Наличие Лейденской мутации означает,что с вероятностью 99,95…99,80% у васНЕ будет венозной тромбоэмболии (ВТЭ) в течение следующего годаАбсолютный риск ВТЭ настолько мал, что даже увеличение в разы не делает его существенным для жизни отдельного конкретного человека. Беременность в совокупности с Лейденской мутацией повышает риск ВТЭ, но шанс на то, что тромбоза НЕ будет, всё равно не опускается ниже 95%. |
1. «Вылечить» полиморфизмы нельзя
Это часть генотипа, и он останется неизменным до конца жизни. Поэтому тактика «сдать на полиморфизмы – полечить – сдать контрольный анализ» абсурдна по своей сути.
2. Ни один из полиморфизмов не является прямым поводом для назначения лечения
Справедливости ради, стоит отметить, что при невынашивании беременности антикоагулянтная терапия может потребоваться, и она дает неплохие результаты. Но для назначения антикоагулянтов должен быть установлен диагноз «антифосфолипидный синдром» (который может сочетаться или не сочетаться с полиморфизмами в генах системы свертывания).
3. Курантил, актовегин, тромбоасс, пиявки не нужны
Они не имеют доказанной эффективности в улучшении исходов беременности у женщин с полиморфизмами в системе свертывания.
https://www.youtube.com/watch?v=RuA0uXdZJfQ
Тестирование женщин даже с неоднократной потерей беременности на наследственные тромбофилии[5] и полиморфизмы фолатного цикла[6] не входит в рекомендации ведущих медицинских организаций, занимающихся этой проблемой. Но в большинстве отечественных «методичек» и рекомендаций по невынашиванию беременности эти исследования входят.
И чтобы не оставлять неопределенности:
Анализы на генетические полиморфизмы женщинам, столкнувшимся с потерей беременности один или несколько раз, делать не нужно
Источники:
[1]https://www.acog.org/Resources-And-Publications/Practice-Bulletins/Committee-on-Practice-Bulletins-Gynecology/Early-Pregnancy-Loss [2] https://www.webmd.com/baby/guide/pregnancy-miscarriage#1 [3] http://emedicine.medscape.com/article/260495-overview#a11 [4] Scott M. Stevens et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis (2016) 41:154–164 [5] Evaluation and treatment of recurrent pregnancy loss: a committee opinion [6] Thrombophilias and recurrent pregnancy loss: a critical appraisal of the literatureКарпачева Клавдия, молекулярный генетик
Источник: http://RumyantsevaMD.ru/polimorphysmy/
Фолатный цикл, полиморфизм генов (MTHFR, MTR, MTRR)
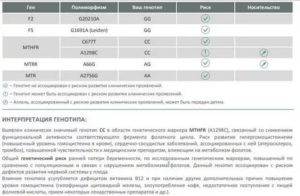
Фолаты – производные фолиевой кислоты (витамина B9), играющие ведущую роль в широком спектре жизненно важных процессов: стимулируют эритропоэз, участвуют в синтезе аминокислот, нуклеиновых кислот, пуринов, пиримидинов, витаминов, участвуют в обмене холина, гистидина, в метилировании ДНК и РНК, способствуют регенерации мышечной ткани, развитию быстро растущих тканей (кожа, оболочки ЖКТ, костный мозг), выполняют защитную роль при беременности от тератогенных и повреждающих факторов на плод, способствуют созреванию и функционированию плаценты, оказывают эстрогеноподобное действие. Данные функции реализуются в процессе Фолатного цикла – это каскадный процесс синтеза аминокислоты метионина из гомоцистеина, контролируемый 3-мя ферментами: метилентетрагидрофолатредуктазой (MTHFR), метионин-синтазой (MTR) и метионин-синтаза-редуктазой (MTRR). В фолатном цикле фолаты являются коферментами. Главные причины нарушения фолатного цикла: 1. Генетические дефекты ферментов фолатного цикла MTHFR, MTR и MTRR. 2 Дефицит витаминов: фолиевой кислоты, витаминов В6 и В12, участвующих в обмене фолатов. Генетические дефекты ферментов приводят к снижению их функциональной активности, нарушению фолатного цикла, накоплению гомоцистеина в клетках и повышению уровня гомоцистеина в плазме крови, который оказывает выраженное тромбофилическое, токсическое, атерогенное действие и обусловливает повышенный риск развития ряда патологических процессов: * Осложнения беременности (фетоплацентарная недостаточность, преждевременная отслойка нормально расположенной плаценты, поздний гестоз) * Пренатальная смерть и дефекты развития плода (незаращение нервной трубки, анэнцефалии, деформации лицевого скелета) * Сердечно-сосудистые заболевания (ишемическая болезнь сердца, атеросклероз, инфаркт миокарда, тромбозы) * Канцерогенез (колоректальная аденома, рак молочной железы и яичника) и усиление побочных эффектов при химиотерапии * Эктопия хрусталика * Остеопороз
Показания для назначения
1. Акушерская патология: привычное невынашивание, антенатальная гибель плода, поздние гестозы, преждевременная отслойка плаценты, неудачные попытки ЭКО, синдром задержки внутриутробного развития плода, рождение ребенка с изолированными пороками нервной трубки, сердца или урогенитального тракта.
2.
Плановая подготовка к беременности при отягощенной наследственности (с акушерской патологией и сосудистым тромбозом в анамнезе, наличие родственников первой степени родства с наследственной тромбофилией и сердечно-сосудистыми катастрофами, особенно в раннем возрасте и др.)
3.
В гинекологии: планирование или применение гормональной контрацепции, гормональной заместительной терапии у женщин, имеющих тромбозы в анамнезе и/или родственников первой степени родства с наследственной тромбофилией и тромбоэмболическими осложнениями, при планировании гинекологических операций.
4.
Наличие сосудистого тромбоза в анамнезе: единичный тромбоз до 50 лет, повторные тромбозы, тромбозы необычной локализации (портальные, брыжеечные, мозговые вены), случаи наследственной тромбоэмболии и тромбоза в любом возрасте.
5. Сердечно-сосудистые заболевания: ишемическая болезнь сердца, артериальная гипертензия, атеросклероз и др.
6.
Ситуации высокого риска: повышенный уровень гомоцистеина в крови (гипергомоцистеинемия), массивные хирургические вмешательства — перед трансплантацией, эндопротезированием и др., длительная иммобилизация, семейная предрасположенность к онкологическим заболеваниям и назначение химиотерапии.
Маркер
Маркер генетических мутаций фолатного цикла.
Клиническая значимость
Исследование Полиморфизм генов Фолатного цикла (MTHFR, MTR, MTRR) проводится для диагностики причины и риска развития тромбофилии, связанной с нарушением обмена фолиевой кислоты и гипергомоцистеинемией.
Анализ полиморфизмов в генах фолатного цикла позволяет определить предрасположенность к опасным для жизни заболеваниям, связанным с нарушением обмена фолиевой кислоты, гипергомоцистеинемией и дает возможность своевременно назначить корректирующую терапию
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Метод: Полимеразная цепная реакция в реальном времени
Диапазон измерений: 300
Референтные значения:
Биологический материал
Условия доставки
Контейнер
Объем
Цельная кровь
Условия доставки:
24 Час. при температуре от 2 до 8 градусов Цельсия
Контейнер:
Система с ЭДТА без разделительного геля
Стандартные условия: утром до 11.00, натощак, через 8-12 часов периода голодания. Особой подготовки не требуется. Важно: !!!Не курить в течение 30 минут до сдачи крови.
Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Не обнаружена.
- Не обнаружена.
Интерпретация:
- Генетическое исследование выявляет в определенном участке ДНК замену нуклеотида, приводящее к замене аминокислотного состава белка и соответственно изменению биохимических свойств фермента.
В результате нуклеотидных замен в кодирующем гене фермента снижается его функциональная активность.
Выявляют несколько вариантов генотипа (сочетание аллелей гена), влияющих на изменение функции кодируемого им фермента: аллель «нейтральный» – нормальная активность фермента, «гетерозигота по мутантному аллелю» — сниженная активность фермента, «гомозигота по мутантному аллелю» — значительно сниженная активность фермента.
Сниженная активность фермента приводит к нарушению метаболического пути превращения гомоцистеина, увеличению его содержание в плазме крови (гипергомоцистеинемии) и вероятности развития патологических состояний.
Образец результата (PDF)
Источник: https://dila.ua/rus/labdir/4362.html
